Spannende und gespannte Moleküle
11
die zu lösende Bindung „gespannt“ ist. In Tabelle 1 sind die freien Aktivierungs-
enthalpien für drei Verbindungen angegeben, die alle eine 1,5-Hexadieneinheit
enthalten. Durch Ersatz der normalen C,C-Einfachbindung im 1,5-Hexadien durch
die gespannte Einfachbindung eines Dreirings im cis-Divinylcyclopropan (Mitte)
wird die freie Aktivierungsenthalpie drastisch reduziert. Bei 4,6-Dimethylen-
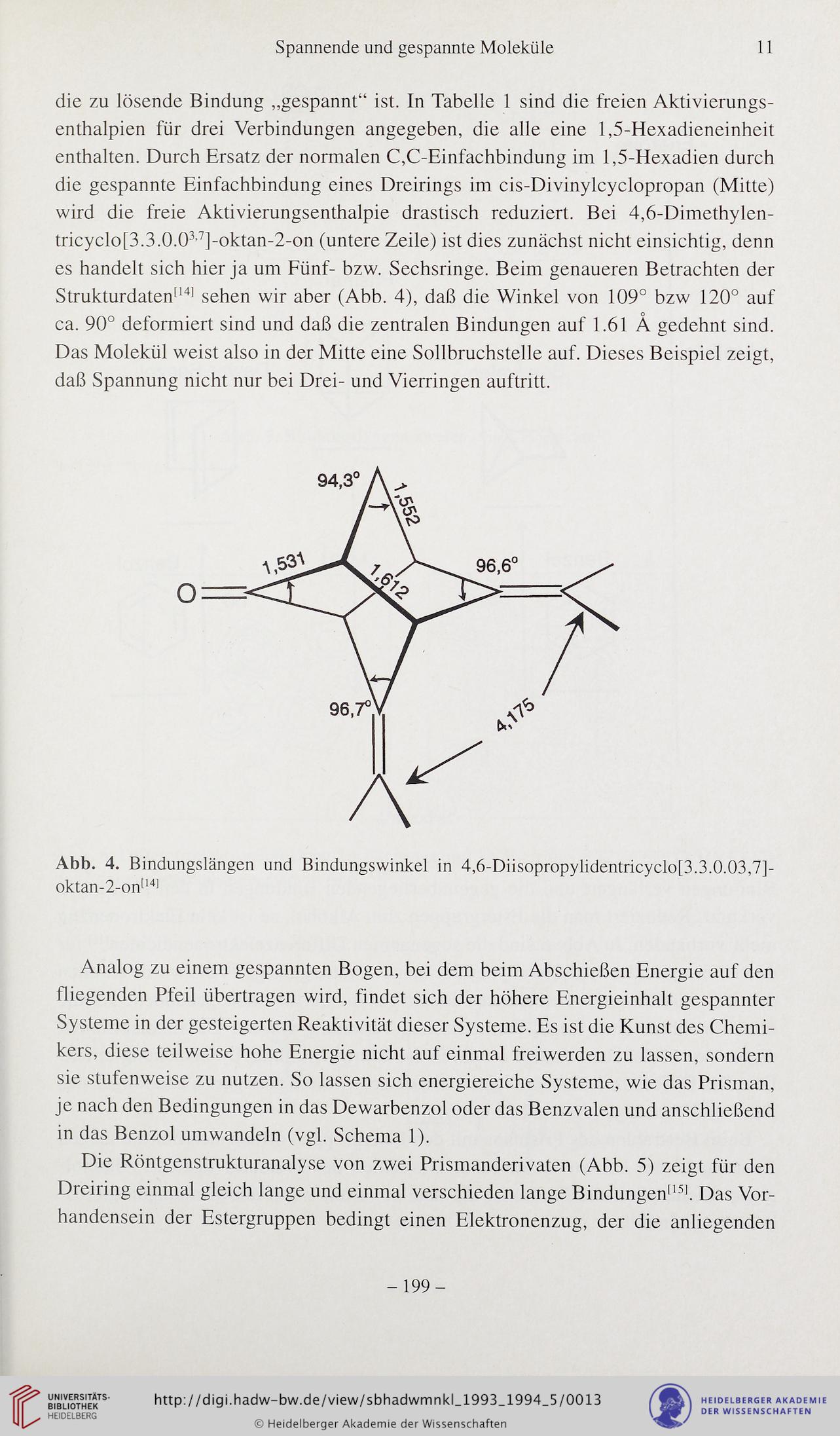
tricyclo[3.3.0.037]-oktan-2-on (untere Zeile) ist dies zunächst nicht einsichtig, denn
es handelt sich hier ja um Fünf- bzw. Sechsringe. Beim genaueren Betrachten der
Strukturdaten[14] sehen wir aber (Abb. 4), daß die Winkel von 109° bzw 120° auf
ca. 90° deformiert sind und daß die zentralen Bindungen auf 1.61 A gedehnt sind.
Das Molekül weist also in der Mitte eine Sollbruchstelle auf. Dieses Beispiel zeigt,
daß Spannung nicht nur bei Drei- und Vierringen auftritt.
Abb. 4. Bindungslängen und Bindungswinkel in 4,6-Diisopropylidentricyclo[3.3.0.03,7]-
oktan-2-on1141
Analog zu einem gespannten Bogen, bei dem beim Abschießen Energie auf den
fliegenden Pfeil übertragen wird, findet sich der höhere Energieinhalt gespannter
Systeme in der gesteigerten Reaktivität dieser Systeme. Es ist die Kunst des Chemi-
kers, diese teilweise hohe Energie nicht auf einmal freiwerden zu lassen, sondern
sie stufenweise zu nutzen. So lassen sich energiereiche Systeme, wie das Prisman,
je nach den Bedingungen in das Dewarbenzol oder das Benzvalen und anschließend
in das Benzol umwandeln (vgl. Schema 1).
Die Röntgenstrukturanalyse von zwei Prismanderivaten (Abb. 5) zeigt für den
Dreiring einmal gleich lange und einmal verschieden lange Bindungen1151. Das Vor-
handensein der Estergruppen bedingt einen Elektronenzug, der die anliegenden
- 199-
11
die zu lösende Bindung „gespannt“ ist. In Tabelle 1 sind die freien Aktivierungs-
enthalpien für drei Verbindungen angegeben, die alle eine 1,5-Hexadieneinheit
enthalten. Durch Ersatz der normalen C,C-Einfachbindung im 1,5-Hexadien durch
die gespannte Einfachbindung eines Dreirings im cis-Divinylcyclopropan (Mitte)
wird die freie Aktivierungsenthalpie drastisch reduziert. Bei 4,6-Dimethylen-
tricyclo[3.3.0.037]-oktan-2-on (untere Zeile) ist dies zunächst nicht einsichtig, denn
es handelt sich hier ja um Fünf- bzw. Sechsringe. Beim genaueren Betrachten der
Strukturdaten[14] sehen wir aber (Abb. 4), daß die Winkel von 109° bzw 120° auf
ca. 90° deformiert sind und daß die zentralen Bindungen auf 1.61 A gedehnt sind.
Das Molekül weist also in der Mitte eine Sollbruchstelle auf. Dieses Beispiel zeigt,
daß Spannung nicht nur bei Drei- und Vierringen auftritt.
Abb. 4. Bindungslängen und Bindungswinkel in 4,6-Diisopropylidentricyclo[3.3.0.03,7]-
oktan-2-on1141
Analog zu einem gespannten Bogen, bei dem beim Abschießen Energie auf den
fliegenden Pfeil übertragen wird, findet sich der höhere Energieinhalt gespannter
Systeme in der gesteigerten Reaktivität dieser Systeme. Es ist die Kunst des Chemi-
kers, diese teilweise hohe Energie nicht auf einmal freiwerden zu lassen, sondern
sie stufenweise zu nutzen. So lassen sich energiereiche Systeme, wie das Prisman,
je nach den Bedingungen in das Dewarbenzol oder das Benzvalen und anschließend
in das Benzol umwandeln (vgl. Schema 1).
Die Röntgenstrukturanalyse von zwei Prismanderivaten (Abb. 5) zeigt für den
Dreiring einmal gleich lange und einmal verschieden lange Bindungen1151. Das Vor-
handensein der Estergruppen bedingt einen Elektronenzug, der die anliegenden
- 199-