324
FÖRDERUNG DES WISSENSCHAFTLICHEN NACHWUCHSES
2.3. Alters abhängige Genexpressionsproftle in MSC und HSC sowie epigenetische
Untersuchungen in MSC
Genomweite Vergleiche der mRNA-Expressionsprofile von mesenchymalen und
hämatopoetischen Stammzellen von jungen und alten Spendern wurden mittels
Microarrays untersucht. Dazu wurden HSC und MSC von Menschen unterschied-
lichen Alters (0—92 Jahre) isoliert. Wir konnten zeigen, dass sowohl HSC als auch
MSC ihre Genexpression im Verlauf der Alterung signifikant verändern. Zusätzlich
haben wir die Ergebnisse mit den Daten zur in tWo-Seneszenz in Verbindung
gebracht und konnten beobachten, dass sich viele Seneszenz-assoziierte Veränderun-
gen auch im Genexpressionsmuster von MSC und HSC aus alten Spendern wider-
spiegeln12. Besonders Gene mit einer Beteiligung an der Genomintegrität und der
Transkriptionskontrolle zeigten sich in den Stammzellen von älteren Spendern her-
unterreguliert. Diese Daten deuten darauf hin, dass unsere adulten Stammzellen
nicht nur der in utro-Seneszenz unterliegen, sondern auch in vivo einem Alterungs-
prozess unterworfen sind und diese zwei Prozesse möglicherweise auf ähnlichen
molekularen Mechanismen beruhen.
Epigenetische Veränderungen der Zelle scheinen eine weitere molekulare
Grundlage für das Phänomen der Seneszenz und des Alterns zu sein. Wir haben des-
halb die genomweiten DNA-Methylierungsmuster von MSC von frühen oder
späten Passagen bzw. jungen und alten Spendern quantitativ bestimmt und mit-
einander verglichen13. Wir konnten zeigen, dass MSC im Verlauf der replikativen
Seneszenz hochinteressante Änderungen in ihrem DNA-Methylierungsmuster
akquirieren. Diese betreffen unter anderem verschiedene Homeoboxgene und
Differenzierungsassoziierte Gene. Mittels Pyrosequenzierung konnten wir die beob-
achteten Veränderungen validieren und zeigen, dass die Veränderungen ganze CpG-
Inseln betreffen.
MSC Proliferation Curves
days of cultivation
MSC-AML
> KM37
KM44
KM50
KM55
KM56
KM69
KM70
KM72
KM74
KM75
MSC - healthy
-♦ Spender338
Spender340
8pender341
— Spender342
-x- Spender343
-* Spender344
-t- Spender345
- Spender346
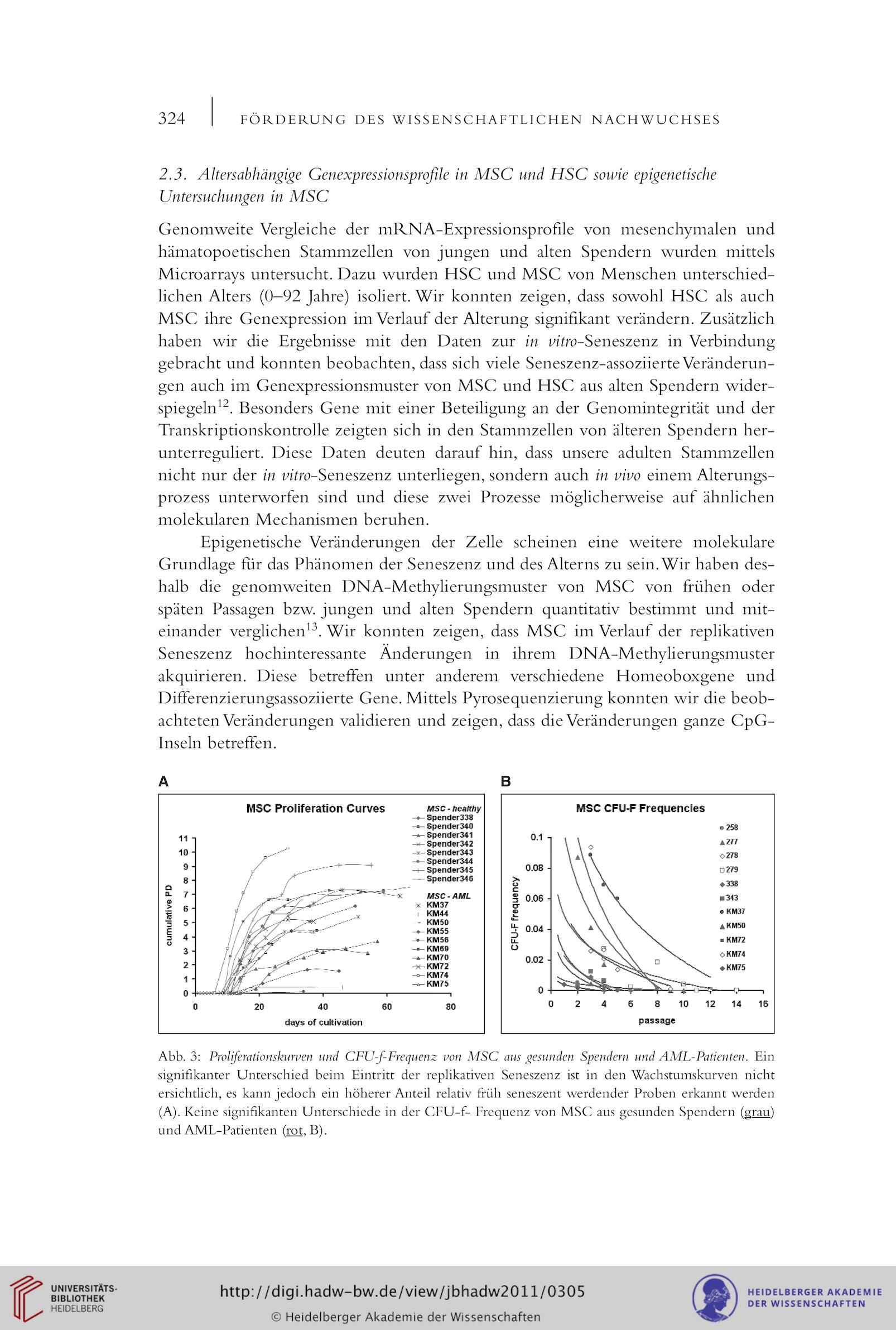
Abb. 3: Proliferationskuruen und CFU-f-Frequenz mn MSC aus gesunden Spendern und AML-Patienten. Ein
signifikanter Unterschied beim Eintritt der replikativen Seneszenz ist in den Wachstuniskurven nicht
ersichtlich, es kann jedoch ein höherer Anteil relativ früh seneszent werdender Proben erkannt werden
(A). Keine signifikanten Unterschiede in der CFU-f- Frequenz von MSC aus gesunden Spendern (grau)
und AML-Patienten (rot. B).
FÖRDERUNG DES WISSENSCHAFTLICHEN NACHWUCHSES
2.3. Alters abhängige Genexpressionsproftle in MSC und HSC sowie epigenetische
Untersuchungen in MSC
Genomweite Vergleiche der mRNA-Expressionsprofile von mesenchymalen und
hämatopoetischen Stammzellen von jungen und alten Spendern wurden mittels
Microarrays untersucht. Dazu wurden HSC und MSC von Menschen unterschied-
lichen Alters (0—92 Jahre) isoliert. Wir konnten zeigen, dass sowohl HSC als auch
MSC ihre Genexpression im Verlauf der Alterung signifikant verändern. Zusätzlich
haben wir die Ergebnisse mit den Daten zur in tWo-Seneszenz in Verbindung
gebracht und konnten beobachten, dass sich viele Seneszenz-assoziierte Veränderun-
gen auch im Genexpressionsmuster von MSC und HSC aus alten Spendern wider-
spiegeln12. Besonders Gene mit einer Beteiligung an der Genomintegrität und der
Transkriptionskontrolle zeigten sich in den Stammzellen von älteren Spendern her-
unterreguliert. Diese Daten deuten darauf hin, dass unsere adulten Stammzellen
nicht nur der in utro-Seneszenz unterliegen, sondern auch in vivo einem Alterungs-
prozess unterworfen sind und diese zwei Prozesse möglicherweise auf ähnlichen
molekularen Mechanismen beruhen.
Epigenetische Veränderungen der Zelle scheinen eine weitere molekulare
Grundlage für das Phänomen der Seneszenz und des Alterns zu sein. Wir haben des-
halb die genomweiten DNA-Methylierungsmuster von MSC von frühen oder
späten Passagen bzw. jungen und alten Spendern quantitativ bestimmt und mit-
einander verglichen13. Wir konnten zeigen, dass MSC im Verlauf der replikativen
Seneszenz hochinteressante Änderungen in ihrem DNA-Methylierungsmuster
akquirieren. Diese betreffen unter anderem verschiedene Homeoboxgene und
Differenzierungsassoziierte Gene. Mittels Pyrosequenzierung konnten wir die beob-
achteten Veränderungen validieren und zeigen, dass die Veränderungen ganze CpG-
Inseln betreffen.
MSC Proliferation Curves
days of cultivation
MSC-AML
> KM37
KM44
KM50
KM55
KM56
KM69
KM70
KM72
KM74
KM75
MSC - healthy
-♦ Spender338
Spender340
8pender341
— Spender342
-x- Spender343
-* Spender344
-t- Spender345
- Spender346
Abb. 3: Proliferationskuruen und CFU-f-Frequenz mn MSC aus gesunden Spendern und AML-Patienten. Ein
signifikanter Unterschied beim Eintritt der replikativen Seneszenz ist in den Wachstuniskurven nicht
ersichtlich, es kann jedoch ein höherer Anteil relativ früh seneszent werdender Proben erkannt werden
(A). Keine signifikanten Unterschiede in der CFU-f- Frequenz von MSC aus gesunden Spendern (grau)
und AML-Patienten (rot. B).