Sprachliche Texte - Genetische Texte
41
(vgl. 2.2)43. Nun begann speziell eine Suche nach Stellen in der
Umgebung von Genen der Eukaryoten, an denen sich bestimmte
Motive wiederholen, die durch ihre Raumeigenschaften besonders
günstige Erkennungsmerkmale für Proteine darstellen. Ein Beispiel
ist der 1987 nach dreijähriger harter Arbeit in seiner Struktur und
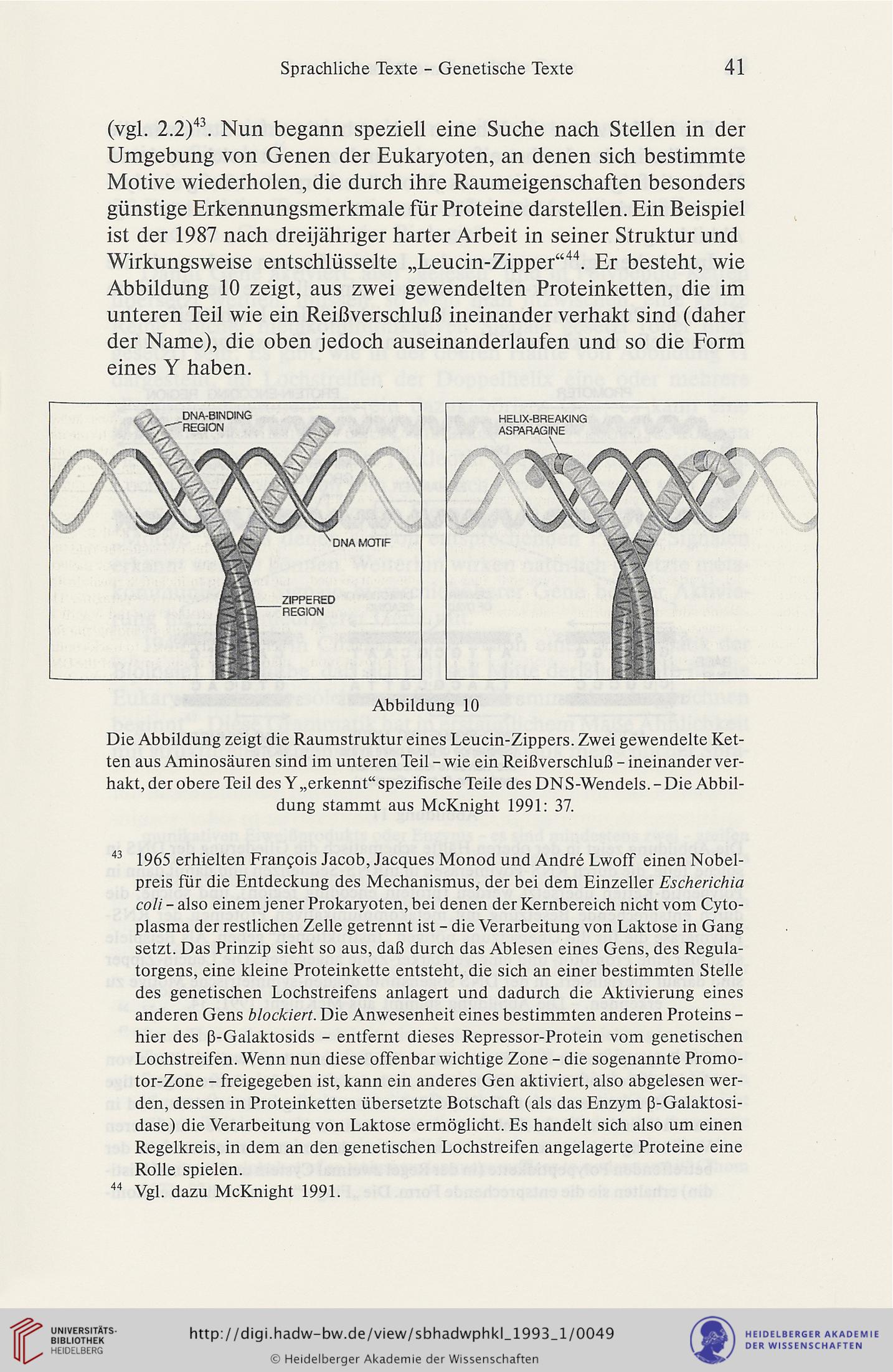
Wirkungsweise entschlüsselte „Leucin-Zipper“44. Er besteht, wie
Abbildung 10 zeigt, aus zwei gewendelten Proteinketten, die im
unteren Teil wie ein Reißverschluß ineinander verhakt sind (daher
der Name), die oben jedoch auseinanderlaufen und so die Form
eines Y haben.
Abbildung 10
Die Abbildung zeigt die Raumstruktur eines Leucin-Zippers. Zwei gewendelte Ket-
ten aus Aminosäuren sind im unteren Teil - wie ein Reißverschluß - ineinander ver-
hakt, der obere Teil des Y„erkennt“ spezifische Teile des DNS-Wendels. - Die Abbil-
dung stammt aus McKnight 1991: 37.
43 1965 erhielten Francois Jacob, Jacques Monod und Andre Lwoff einen Nobel-
preis für die Entdeckung des Mechanismus, der bei dem Einzeller Escherichia
coli - also einem jener Prokaryoten, bei denen der Kernbereich nicht vom Cyto-
plasma der restlichen Zelle getrennt ist - die Verarbeitung von Laktose in Gang
setzt. Das Prinzip sieht so aus, daß durch das Ablesen eines Gens, des Regula-
torgens, eine kleine Proteinkette entsteht, die sich an einer bestimmten Stelle
des genetischen Lochstreifens anlagert und dadurch die Aktivierung eines
anderen Gens blockiert. Die Anwesenheit eines bestimmten anderen Proteins -
hier des ß-Galaktosids - entfernt dieses Repressor-Protein vom genetischen
Lochstreifen. Wenn nun diese offenbar wichtige Zone - die sogenannte Promo-
tor-Zone - freigegeben ist, kann ein anderes Gen aktiviert, also abgelesen wer-
den, dessen in Proteinketten übersetzte Botschaft (als das Enzym ß-Galaktosi-
dase) die Verarbeitung von Laktose ermöglicht. Es handelt sich also um einen
Regelkreis, in dem an den genetischen Lochstreifen angelagerte Proteine eine
Rolle spielen.
44 Vgl. dazu McKnight 1991.
41
(vgl. 2.2)43. Nun begann speziell eine Suche nach Stellen in der
Umgebung von Genen der Eukaryoten, an denen sich bestimmte
Motive wiederholen, die durch ihre Raumeigenschaften besonders
günstige Erkennungsmerkmale für Proteine darstellen. Ein Beispiel
ist der 1987 nach dreijähriger harter Arbeit in seiner Struktur und
Wirkungsweise entschlüsselte „Leucin-Zipper“44. Er besteht, wie
Abbildung 10 zeigt, aus zwei gewendelten Proteinketten, die im
unteren Teil wie ein Reißverschluß ineinander verhakt sind (daher
der Name), die oben jedoch auseinanderlaufen und so die Form
eines Y haben.
Abbildung 10
Die Abbildung zeigt die Raumstruktur eines Leucin-Zippers. Zwei gewendelte Ket-
ten aus Aminosäuren sind im unteren Teil - wie ein Reißverschluß - ineinander ver-
hakt, der obere Teil des Y„erkennt“ spezifische Teile des DNS-Wendels. - Die Abbil-
dung stammt aus McKnight 1991: 37.
43 1965 erhielten Francois Jacob, Jacques Monod und Andre Lwoff einen Nobel-
preis für die Entdeckung des Mechanismus, der bei dem Einzeller Escherichia
coli - also einem jener Prokaryoten, bei denen der Kernbereich nicht vom Cyto-
plasma der restlichen Zelle getrennt ist - die Verarbeitung von Laktose in Gang
setzt. Das Prinzip sieht so aus, daß durch das Ablesen eines Gens, des Regula-
torgens, eine kleine Proteinkette entsteht, die sich an einer bestimmten Stelle
des genetischen Lochstreifens anlagert und dadurch die Aktivierung eines
anderen Gens blockiert. Die Anwesenheit eines bestimmten anderen Proteins -
hier des ß-Galaktosids - entfernt dieses Repressor-Protein vom genetischen
Lochstreifen. Wenn nun diese offenbar wichtige Zone - die sogenannte Promo-
tor-Zone - freigegeben ist, kann ein anderes Gen aktiviert, also abgelesen wer-
den, dessen in Proteinketten übersetzte Botschaft (als das Enzym ß-Galaktosi-
dase) die Verarbeitung von Laktose ermöglicht. Es handelt sich also um einen
Regelkreis, in dem an den genetischen Lochstreifen angelagerte Proteine eine
Rolle spielen.
44 Vgl. dazu McKnight 1991.