42
Wolfgang Raible
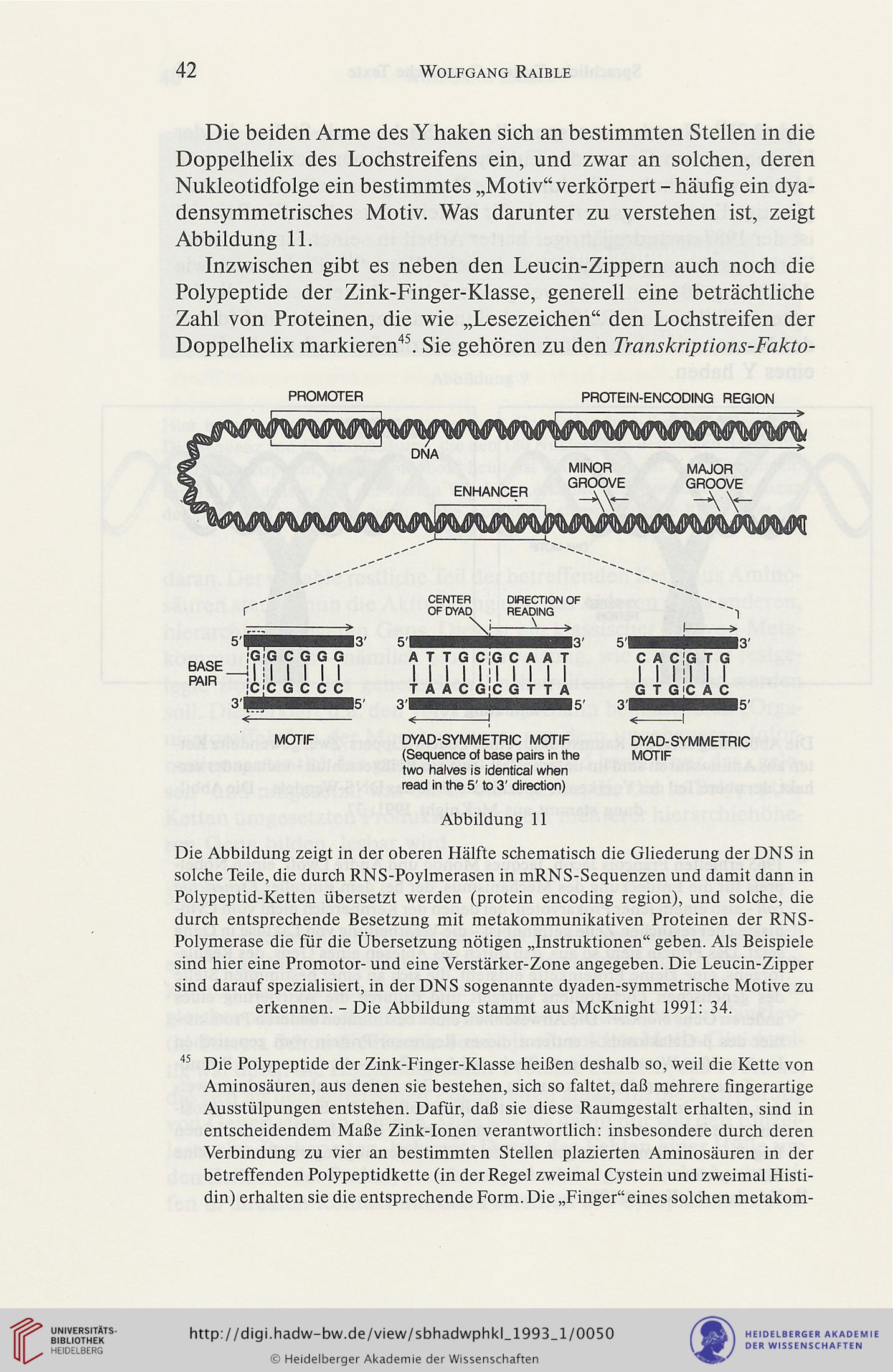
Die beiden Arme des Y haken sich an bestimmten Stellen in die
Doppelhelix des Lochstreifens ein, und zwar an solchen, deren
Nukleotidfolge ein bestimmtes „Motiv“ verkörpert - häufig ein dya-
densymmetrisches Motiv. Was darunter zu verstehen ist, zeigt
Abbildung 11.
Inzwischen gibt es neben den Leucin-Zippern auch noch die
Polypeptide der Zink-Finger-Klasse, generell eine beträchtliche
Zahl von Proteinen, die wie „Lesezeichen“ den Lochstreifen der
Doppelhelix markieren45. Sie gehören zu den Transkriptions-Fakto-
read in the 5' to 3' direction)
Abbildung 11
Die Abbildung zeigt in der oberen Hälfte schematisch die Gliederung der DN S in
solche Teile, die durch RNS-Poylmerasen in mRNS-Sequenzen und damit dann in
Polypeptid-Ketten übersetzt werden (protein encoding region), und solche, die
durch entsprechende Besetzung mit metakommunikativen Proteinen der RNS-
Polymerase die für die Übersetzung nötigen „Instruktionen“ geben. Als Beispiele
sind hier eine Promotor- und eine Verstärker-Zone angegeben. Die Leucin-Zipper
sind darauf spezialisiert, in der DNS sogenannte dyaden-symmetrische Motive zu
erkennen. - Die Abbildung stammt aus McKnight 1991: 34.
45 Die Polypeptide der Zink-Finger-Klasse heißen deshalb so, weil die Kette von
Aminosäuren, aus denen sie bestehen, sich so faltet, daß mehrere fingerartige
Ausstülpungen entstehen. Dafür, daß sie diese Raumgestalt erhalten, sind in
entscheidendem Maße Zink-Ionen verantwortlich: insbesondere durch deren
Verbindung zu vier an bestimmten Stellen plazierten Aminosäuren in der
betreffenden Polypeptidkette (in der Regel zweimal Cystein und zweimal Histi-
din) erhalten sie die entsprechende Form. Die „Finger“eines solchen metakom-
Wolfgang Raible
Die beiden Arme des Y haken sich an bestimmten Stellen in die
Doppelhelix des Lochstreifens ein, und zwar an solchen, deren
Nukleotidfolge ein bestimmtes „Motiv“ verkörpert - häufig ein dya-
densymmetrisches Motiv. Was darunter zu verstehen ist, zeigt
Abbildung 11.
Inzwischen gibt es neben den Leucin-Zippern auch noch die
Polypeptide der Zink-Finger-Klasse, generell eine beträchtliche
Zahl von Proteinen, die wie „Lesezeichen“ den Lochstreifen der
Doppelhelix markieren45. Sie gehören zu den Transkriptions-Fakto-
read in the 5' to 3' direction)
Abbildung 11
Die Abbildung zeigt in der oberen Hälfte schematisch die Gliederung der DN S in
solche Teile, die durch RNS-Poylmerasen in mRNS-Sequenzen und damit dann in
Polypeptid-Ketten übersetzt werden (protein encoding region), und solche, die
durch entsprechende Besetzung mit metakommunikativen Proteinen der RNS-
Polymerase die für die Übersetzung nötigen „Instruktionen“ geben. Als Beispiele
sind hier eine Promotor- und eine Verstärker-Zone angegeben. Die Leucin-Zipper
sind darauf spezialisiert, in der DNS sogenannte dyaden-symmetrische Motive zu
erkennen. - Die Abbildung stammt aus McKnight 1991: 34.
45 Die Polypeptide der Zink-Finger-Klasse heißen deshalb so, weil die Kette von
Aminosäuren, aus denen sie bestehen, sich so faltet, daß mehrere fingerartige
Ausstülpungen entstehen. Dafür, daß sie diese Raumgestalt erhalten, sind in
entscheidendem Maße Zink-Ionen verantwortlich: insbesondere durch deren
Verbindung zu vier an bestimmten Stellen plazierten Aminosäuren in der
betreffenden Polypeptidkette (in der Regel zweimal Cystein und zweimal Histi-
din) erhalten sie die entsprechende Form. Die „Finger“eines solchen metakom-