Das WIN-Kolleg
315
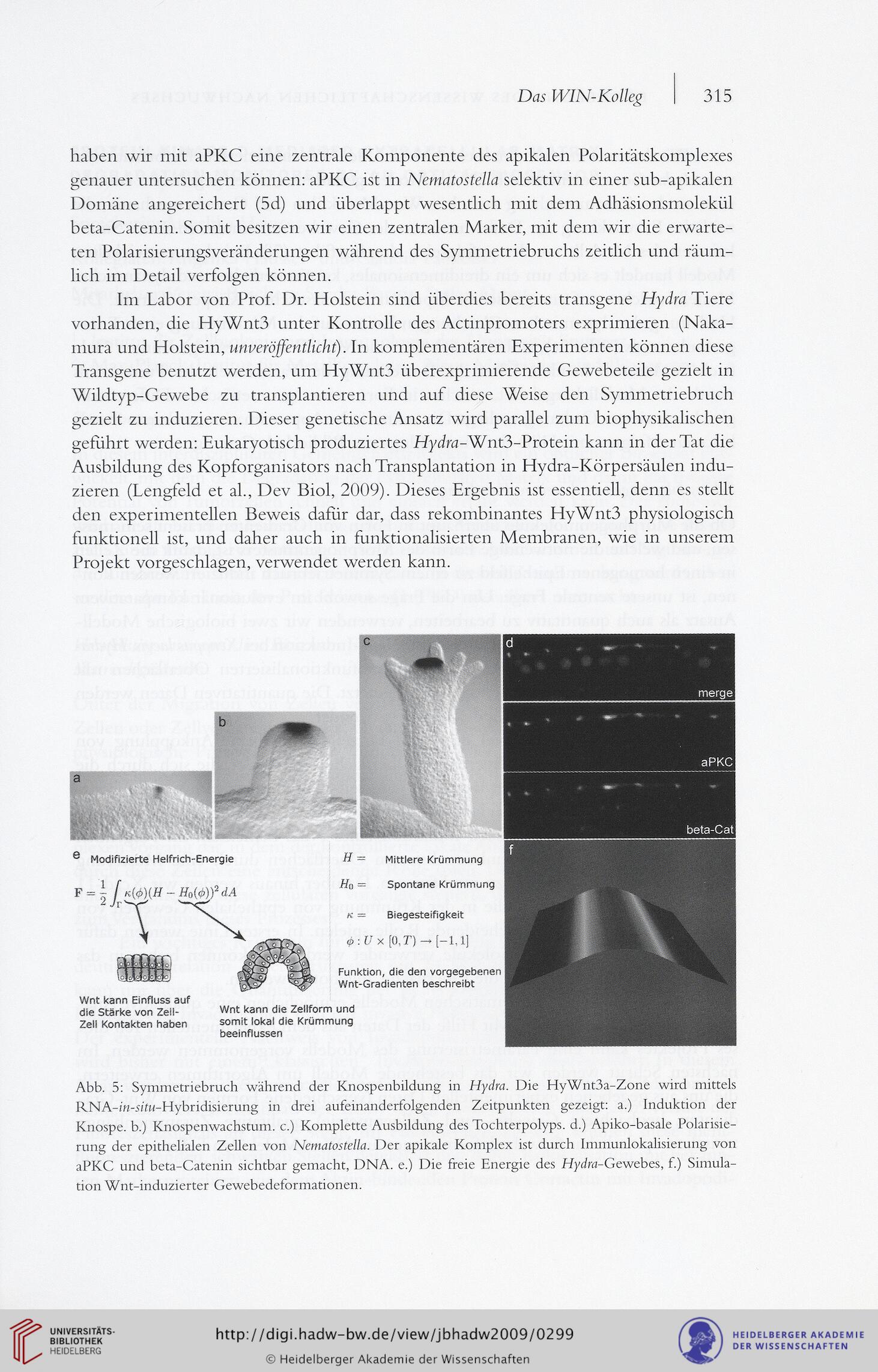
haben wir mit aPKC eine zentrale Komponente des apikalen Polaritätskomplexes
genauer untersuchen können: aPKC ist in Nematostella selektiv in einer sub-apikalen
Domäne angereichert (5d) und überlappt wesentlich mit dem Adhäsionsmolekül
beta-Catenin. Somit besitzen wir einen zentralen Marker, mit dem wir die erwarte-
ten Polarisierungsveränderungen während des Symmetriebruchs zeitlich und räum-
lich im Detail verfolgen können.
Im Labor von Prof. Dr. Holstein sind überdies bereits transgene Hydra Tiere
vorhanden, die HyWnt3 unter Kontrolle des Actinpromoters exprimieren (Naka-
mura und Holstein, unveröffentlicht'). In komplementären Experimenten können diese
Transgene benutzt werden, um HyWnt3 überexprimierende Gewebeteile gezielt in
Wildtyp-Gewebe zu transplantieren und auf diese Weise den Symmetriebruch
gezielt zu induzieren. Dieser genetische Ansatz wird parallel zum biophysikalischen
geführt werden: Eukaryotisch produziertes Hydra-Wnt3-Protein kann in der Tat die
Ausbildung des Kopforganisators nach Transplantation in Hydra-Körpersäulen indu-
zieren (Lengfeld et al., Dev Biol, 2009). Dieses Ergebnis ist essentiell, denn es stellt
den experimentellen Beweis dafür dar, dass rekombinantes HyWnt3 physiologisch
funktionell ist, und daher auch in funktionalisierten Membranen, wie in unserem
Projekt vorgeschlagen, verwendet werden kann.
Wnt kann Einfluss auf
die Stärke von Zell-
Zell Kontakten haben
Wnt kann die Zellform und
somit lokal die Krümmung
beeinflussen
Abb. 5: Symmetriebruch während der Knospenbildung in Hydra. Die HyWnt3a-Zone wird mittels
RNA-in-sttw-Hybridisierung in drei aufeinanderfolgenden Zeitpunkten gezeigt: a.) Induktion der
Knospe, b.) Knospenwachstum, c.) Komplette Ausbildung des Tochterpolyps. d.) Apiko-basale Polarisie-
rung der epithelialen Zellen von Nematostella. Der apikale Komplex ist durch Immunlokalisierung von
aPKC und beta-Catenin sichtbar gemacht, DNA. e.) Die freie Energie des Hydra-Gewebes, f.) Simula-
tion Wnt-induzierter Gewebedeformationen.
315
haben wir mit aPKC eine zentrale Komponente des apikalen Polaritätskomplexes
genauer untersuchen können: aPKC ist in Nematostella selektiv in einer sub-apikalen
Domäne angereichert (5d) und überlappt wesentlich mit dem Adhäsionsmolekül
beta-Catenin. Somit besitzen wir einen zentralen Marker, mit dem wir die erwarte-
ten Polarisierungsveränderungen während des Symmetriebruchs zeitlich und räum-
lich im Detail verfolgen können.
Im Labor von Prof. Dr. Holstein sind überdies bereits transgene Hydra Tiere
vorhanden, die HyWnt3 unter Kontrolle des Actinpromoters exprimieren (Naka-
mura und Holstein, unveröffentlicht'). In komplementären Experimenten können diese
Transgene benutzt werden, um HyWnt3 überexprimierende Gewebeteile gezielt in
Wildtyp-Gewebe zu transplantieren und auf diese Weise den Symmetriebruch
gezielt zu induzieren. Dieser genetische Ansatz wird parallel zum biophysikalischen
geführt werden: Eukaryotisch produziertes Hydra-Wnt3-Protein kann in der Tat die
Ausbildung des Kopforganisators nach Transplantation in Hydra-Körpersäulen indu-
zieren (Lengfeld et al., Dev Biol, 2009). Dieses Ergebnis ist essentiell, denn es stellt
den experimentellen Beweis dafür dar, dass rekombinantes HyWnt3 physiologisch
funktionell ist, und daher auch in funktionalisierten Membranen, wie in unserem
Projekt vorgeschlagen, verwendet werden kann.
Wnt kann Einfluss auf
die Stärke von Zell-
Zell Kontakten haben
Wnt kann die Zellform und
somit lokal die Krümmung
beeinflussen
Abb. 5: Symmetriebruch während der Knospenbildung in Hydra. Die HyWnt3a-Zone wird mittels
RNA-in-sttw-Hybridisierung in drei aufeinanderfolgenden Zeitpunkten gezeigt: a.) Induktion der
Knospe, b.) Knospenwachstum, c.) Komplette Ausbildung des Tochterpolyps. d.) Apiko-basale Polarisie-
rung der epithelialen Zellen von Nematostella. Der apikale Komplex ist durch Immunlokalisierung von
aPKC und beta-Catenin sichtbar gemacht, DNA. e.) Die freie Energie des Hydra-Gewebes, f.) Simula-
tion Wnt-induzierter Gewebedeformationen.